CIENCIA Y TECNOLOGíA
7 de septiembre de 2025
Científicos del CONICET estudiaron una enzima que podría ser un blanco clave para tratar distintos tumores malignos
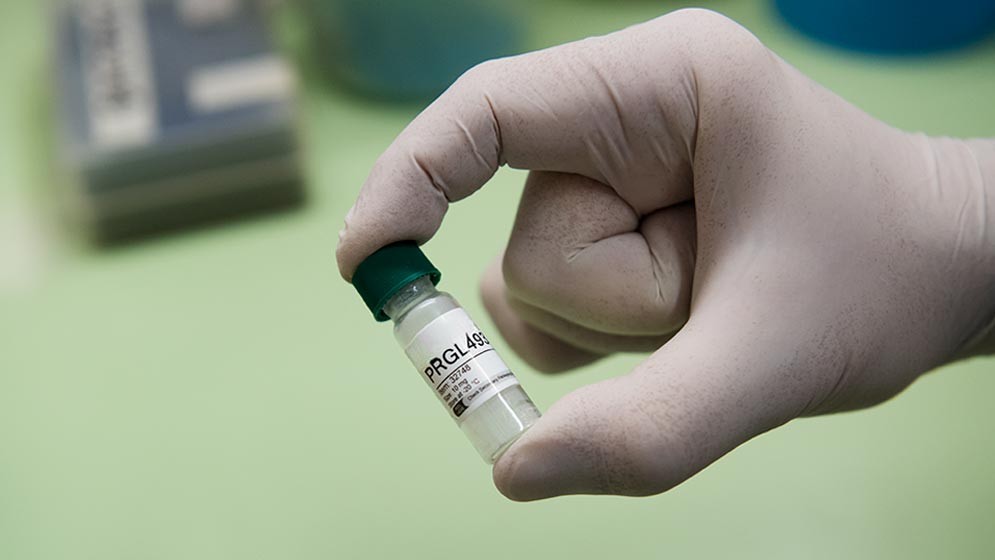
Liderados por el investigador del CONICET Ernesto Podestá, flamante ganador del Premio Cesar Milstein 2025, desarrollaron además un inhibidor con potencial para convertirse en fármaco para combatir patologías cancerígenas.
En el mundo se identifican constantemente nuevas variantes y subtipos de cáncer, y los tratamientos van quedando obsoletos: las células cancerígenas se van volviendo resistentes a las terapias disponibles. Por eso, la búsqueda de nuevos blancos – células o moléculas clave que deben ser atacadas para frenar el crecimiento tumoral–- y el desarrollo de agentes terapéuticos drogas capaces de hacerlo- es el principal desafío del campo de la oncología. En ese escenario, un grupo de científicos del CONICET liderado por Ernesto Podestá e integrado por Paula Mariana Maloberti, Ana Fernanda Castillo y Ulises Daniel Orlando, investigaron la acción de una enzima que podría ser promisoria tanto para comprender cómo funcionan ciertos tipos de cáncer altamente agresivos, como para diseñar una droga para inhibirla.
La enzima que podría cambiar los tratamientos usuales se llama acil-CoA sintetasa 4 (ACSL4) y se encuentra en niveles elevados en tumores -como el cáncer de mama triple negativo, de próstata resistente a castración (CPRC), de hígado y de colon-, y facilita procesos que contribuyen al crecimiento y propagación de las células cancerígenas, pero casi no se encuentra en tejidos normales. Es decir que convertirla en el blanco de un fármaco podría ser la clave para combatir ese tipo de tumores.
ÚNETE A NUESTRO X
Ofrecemos lo más relevante en noticias.
“Argentina es uno de los países con más incidencia de cáncer a nivel mundial: más de cien mil casos nuevos de cáncer se dan por año en el país. El cáncer de mama es el más frecuente en mujeres y el de próstata en hombres. A lo largo de las décadas, se ha avanzado notablemente para combatir esta patología mediante el desarrollo de numerosos tratamientos, principalmente en la quimioterapia, la terapia dirigida y la inmunoterapia, entre otros, que suelen ser efectivos en etapas tempranas de la enfermedad, pero que también generan resistencia”, explica Podestá, cuyo grupo pertenece al Instituto de Investigaciones Biomédicas (INBIOMED, UBA-CONICET).
“La comprensión de los mecanismos de resistencia a los tratamientos en esta enfermedad es crucial para el desarrollo de estrategias terapéuticas más efectivas –continúa el científico Ulises Orlando-. Las investigaciones están siendo dirigidas a identificar estrategias de diagnóstico, monitorización y tratamiento temprano de esta patología para adaptar los tratamientos de manera más precisa a las necesidades individuales de los pacientes. En este contexto, el metabolismo lipídico ha cobrado creciente interés por su rol en la progresión tumoral. Estas biomoléculas están involucradas en la transducción de señales, y junto con los desequilibrios en el metabolismo de lípidos son causantes de una serie de trastornos de alta prevalencia, que van desde la enfermedad cardiovascular, la diabetes, la obesidad y el cáncer entre otras patologías”, señala Maloberti. El equipo de trabajo desarrolló incluso un compuesto que en modelos de laboratorio inhibe la actividad de esta enzima que regula el metabolismo lipídico, y que tiene potencial para convertirse ser un potencial fármaco contra varios tipos de cáncer. Ahora, buscan el modo de financiar los ensayos pre-clínicos necesarios para avanzar en el desarrollo de esta nueva droga como posible tratamiento.
El momento eureka
La enzima ACSL4, que está involucrada en el metabolismo lipídico mencionada por el científico, fue identificada por el equipo de Podestá durante los años noventa, cuando se dedicaba a dilucidar el mecanismo de acción de las hormonas –el sistema endócrino- en el cuerpo y había logrado caracterizar el funcionamiento y las propiedades de ACSL4, porque tenía una función muy importante en el comportamiento hormonal. De pronto, en 1998, en una publicación de un colega de Japón se postuló que esa misma enzima, la ACSL4, estaba sobreexpresada en ciertos tumores, pero desconocía su funcionamiento. Cuando lo vio, Podestá con su equipo decidieron cambiar sus líneas de investigación, y centrarse en dicha enzima, pero no ya desde lo endócrino sino en la oncología. “Teníamos mucha experiencia en esa enzima, así que no lo dudamos”, recuerda Podestá.
Así descubrieron que ACSL4 tenía la función de “catalizar la activación de ácidos grasos, especialmente ácido araquidónico, implicado en procesos inflamatorios y oncogénicos”, explica Podestá. Junto a su equipo de trabajo, durante años, se dedicaron a validar esta enzima como posible blanco terapéutico, primero en casos de cáncer de mama triple negativo. Lograron ver que “promovía el desarrollo y crecimiento tumoral in vivo, es decir en ratones, y que además esa enzima era la misma que impulsaba mecanismos de resistencia a quimioterapia y tratamientos hormonales”, señala Ulises Orlando.
“En los últimos cinco años aparecieron muchos trabajos con esta enzima, porque participa en numerosas patologías. Eso se debe a que en realidad esta enzima es embrionaria y tiene capacidad para regular numerosos mecanismos. La expresión de esta enzima en los primeros estadios del embrión es crucial para el desarrollo. En el adulto, se expresa muy poco, y en los únicos tejidos donde se expresa mucho son en los que trabajamos nosotros, que son los tejidos esteroidogénicos, y en tejidos con patologías. Cuando esta enzima aparece en un tejido en el que no se expresa fisiológicamente, da lugar a la generación de productos lipooxigenados y la alteración de rutas metabólicas”, explica Podestá.
“Empezamos a estudiar en células de cáncer de mama, en dos modelos, uno que es muy agresivo, el cáncer de mama triple negativo y otro que es no agresivo, y vimos que en el más agresivo había mucha expresión de esta enzima y en el otro modelo había muy baja o casi nula expresión. Para demostrar el papel de ACSL4 en estos modelos lo que hicimos fue modificar la expresión: inhibir la expresión en el que era más agresivo, y aumentarla en el que no era tan agresivo. Así demostramos que cuando se cambian los niveles de expresión de la enzima empiezan a cambiar parámetros que tienen que ver con la agresividad: los tumores pasan de ser poco agresivos a muy agresivos. Cuando la inhibíamos, disminuía la proliferación celular, la migración celular, la invasión celular. Ahí empezamos a demostrar que había una relación entre la enzima y el cáncer. La expresión de una sola molécula demostró tener la capacidad de transformar un fenotipo poco agresivo en uno muy agresivo capaz de generar tumores in vivo. Ese fue un experimento crucial”, recuerda Maloberti.
Posible inhibidor
Como no existían en el mercado inhibidores específicos para esta enzima, el mismo grupo implementó un enfoque racional para el descubrimiento de fármacos. “Mediante un arduo proceso, identificamos que si combinábamos tres drogas del mercado, entre las que está el ibuprofeno por ejemplo, obteníamos una inhibición del crecimiento tumoral. Este efecto era conducido por la expresión de ACSL4, es por ello que era importante obtener un inhibidor de esta enzima”. En la identificación del compuesto, tuvieron la colaboración del grupo de Juan B. Rodríguez, de la Facultad de Ciencias Exactas y Naturales de la UBA, y el grupo de Daniel Gómez, de la Universidad de Quilmes, ambos investigadores de CONICET.
“Llamamos a nuestro compuesto PRGL493. El equipo demostró que PRGL493 es un inhibidor específico de ACSL4 que, en células de cáncer de mama y próstata, redujo la proliferación e invasión, restauró la sensibilidad a terapias hormonales y quimioterapéuticas e inhibió la síntesis de andrógenos en células de cáncer prostático. En modelos in vivo, inhibió el crecimiento tumoral”, explica la científica del CONICET Ana Fernanda Castillo. “Los estudios in vivo se hicieron en embrión de pollo y en ratones, en colaboración con el grupo de Hugo Ortega de la Universidad del Litoral, también investigador de CONICET. Esta combinación de efectos terapéuticos en una sola molécula, en efecto, se constituyó como una verdadera innovación científica y tecnológica en materia cáncer”.
Podestá subraya que “PRGL493 como compuesto se patentó recientemente en Estados Unidos y Europa, se encuentra en etapa de comercialización y es usado por grupos internacionales en estudios sobre patologías oncológicas y no oncológicas”,. En tal sentido, la aplicabilidad de PRGL493 se respalda, indica el científico, por su uso exitoso por grupos de investigación internacionales no solo como un prometedor agente terapéutico en modelos oncológicos sino también en diversas patologías, tales como pancreatitis, eventos isquémicos e hipertrofia cardíaca.
“PRGL493 demostró capacidad para inhibir el crecimiento tumoral y sensibilizar células tumorales de mama triple negativo y próstata CPRC a tratamientos convencionales –señala Podestá-. Además, bloqueó la producción endógena de nuevo de esteroides en células de cáncer de próstata, una propiedad no abordada por los tratamientos actuales. Esta combinación de efectos convierte a PRGL493 en un candidato terapéutico innovador con alto potencial de impacto en salud pública. Es una opción estratégica e innovadora”.
Tal como explica el científico, PRGL493 se posiciona como un agente terapéutico de amplio alcance, con capacidad para transformar el abordaje de diversas patologías de gran relevancia en salud pública: no solo por su potencial como terapia innovadora en el tratamiento de cánceres agresivos, sino también en su aplicabilidad en enfermedades no oncológicas de alta prevalencia. “El descubrimiento de la acción de esta proteína y su inhibidor, podría revolucionar los tratamientos convencionales”, se esperanza Podestá, que por su descubrimiento fue el ganador del Premio Milstein 2025. “Estamos buscando financiamiento para hacer los ensayos pre-clínicos, y tenemos mucha confianza en este desarrollo. Se podría llegar a usar el mismo fármaco para tratar varias patologías distintas”, concluye.
Fuente: conicet.gov.ar


















Seguinos