CIENCIA Y TECNOLOGíA
1 de abril de 2021
Nuevas claves para entender el funcionamiento del receptor de glucocorticoides
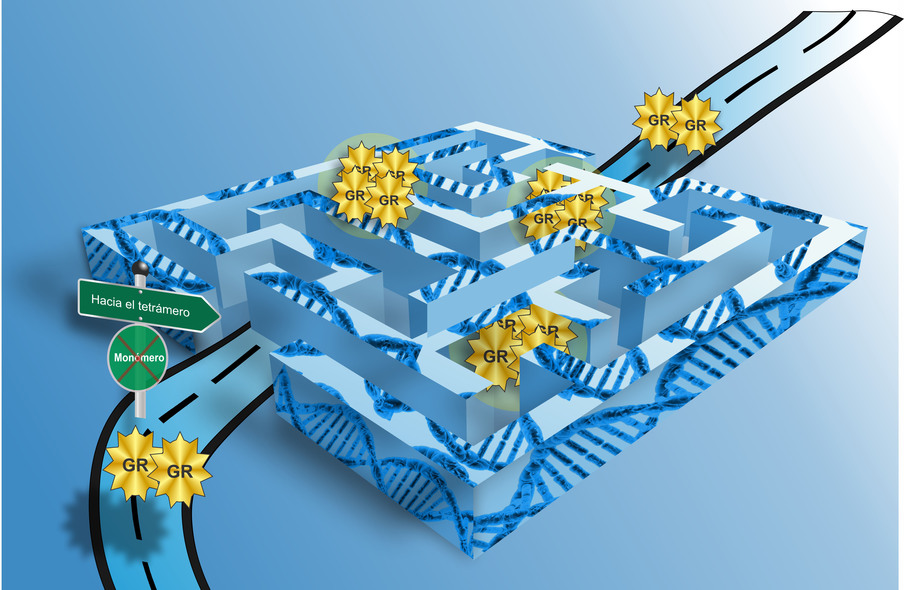
Se trata de una proteína fundamental para el tratamiento de desórdenes inflamatorios y enfermedades autoinmunes. El trabajo, codirigido por un investigador del CONICET, fue publicado en Nature Communications.
Los glucocorticoides son un grupo de hormonas de la familia de los esteroides, cuya secreción se incrementa en situaciones de estrés. Desde el punto de vista farmacológico, desde hace más de medio siglo se sabe que estas hormonas funcionan como agentes antiinflamatorios e inmunosupresores muy efectivos. Por tal motivo, su utilización clínica resulta indispensable en el tratamiento de enfermedades autoinmunes y desórdenes inflamatorios, así como para inhibir el rechazo de trasplantes de órganos. Su uso fue, incluso, una de las primeras estrategias para reducir la mortalidad de pacientes graves con COVID-19.
Pero el tratamiento prolongado con glucocorticoides puede producir también severos y diversos efectos adversos, como diabetes, osteoporosis, atrofia de la piel, redistribución de la grasa, glaucoma, hipertensión arterial, psicosis y neurodegeneración, por nombrar algunos de los más importantes. En este sentido, ya hace muchos años se investiga la posibilidad de poder disociar los importantes resultados benéficos de las terapias con glucocorticoides de sus efectos no deseados.
La acción de los glucocorticoides depende en primer lugar de su unión con un receptor celular, conocido justamente como receptor de glucocorticoides (GR). El GR es lo que se conoce como un factor de transcripción, un tipo de proteínas que se unen a secuencias cortas del ADN, permitiendo de esta forma que los genes se enciendan o se apaguen.
“Comprender cómo funciona el GR, es decir, cómo activa o inactiva ciertos genes, puede llevar al diseño inteligente de drogas sintéticas que solo ocasionen los efectos antiinflamatorios y dejen de lado las consecuencias adversas”, afirma Diego Presman, investigador del CONICET en el Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE, CONICET-UBA) y especialista en el estudio de este receptor.
El GR, al igual que muchos factores de transcripción, se cree que actúa como dímero o tetrámero. Esto significa que su unión al ADN se produce a través de dos o cuatro moléculas de proteína. Cuando la unión se da a través de una sola molécula, se considera que el factor de transcripción actúa como monómero.
“Muchos investigadores creen que si se lograse que el GR se comportara como monómero sólo se activarían los efectos deseados de los glucocorticoides. Esto ha llevado a apostar al desarrollo de drogas que permitan que el GR actué como monómero, pero pasaron ya veinticinco años y todos los intentos en este sentido han resultado infructuosos”, relata Presman.
Desde hace ya algunos años, un equipo internacional de científicos del que participa Presman viene discutiendo las premisas sobre las que se basa dicha apuesta. La búsqueda de una terapia farmacológica para que el GR se comporte como monómero está fundamentada en un estudio de 1998 sobre un ratón mutante cuyo receptor de glucocorticoides supuestamente no formaba dímeros ni se unía al ADN. En estos ratones, los glucocorticoides generaban los efectos antiinflamatorios deseados sin que aparecieran las reacciones adversas.
“Lo primero que descubrimos fue que había problemas en la caracterización del ratón mutante del estudio de 1998, al comprobar que, en realidad, no solo su GR continuaba uniéndose al ADN, sino que también formaba dímeros. Lo que aún desconocemos son los mecanismos por los cuales este mutante responde bien a los efectos antinflamatorios de los glucocorticoides sin generar muchas de las reacciones no deseadas”, comenta el investigador.
Una investigación reciente dirigida por Presman – de la que participaron también científicos de Finlandia y Estados Unidos-, publicada hoy en Nature Communications, avanza un paso más en desmontar la hipótesis que indica que si el GR actuara como una proteína monomérica se allanaría el camino para disociar los efectos buscados de los glucocorticoides de aquellos no deseados.
“Lo que hicimos fue generar y caracterizar un modelo mutante de GR verdaderamente monomérico. Para la sorpresa de todos, cuando el GR actúa como monómero no funciona, es decir, prácticamente no puede unirse al ADN ni, por lo tanto, encender y apagar genes. Esto implicaría que la búsqueda de drogas que favorezcan la formación de monómeros no es la estrategia adecuada para lograr una disminución de los efectos secundarios de los glucocorticoides, como se creía hasta ahora. Esta información podría llevar a reconducir la búsqueda para el desarrollo de nuevas terapias hacia un camino que podría ser más fructífero”, concluye Presman.

















Seguinos