CIENCIA Y TECNOLOGíA
2 de abril de 2023
Especialistas del CONICET obtienen en el laboratorio células con alta capacidad para activar la respuesta inmune
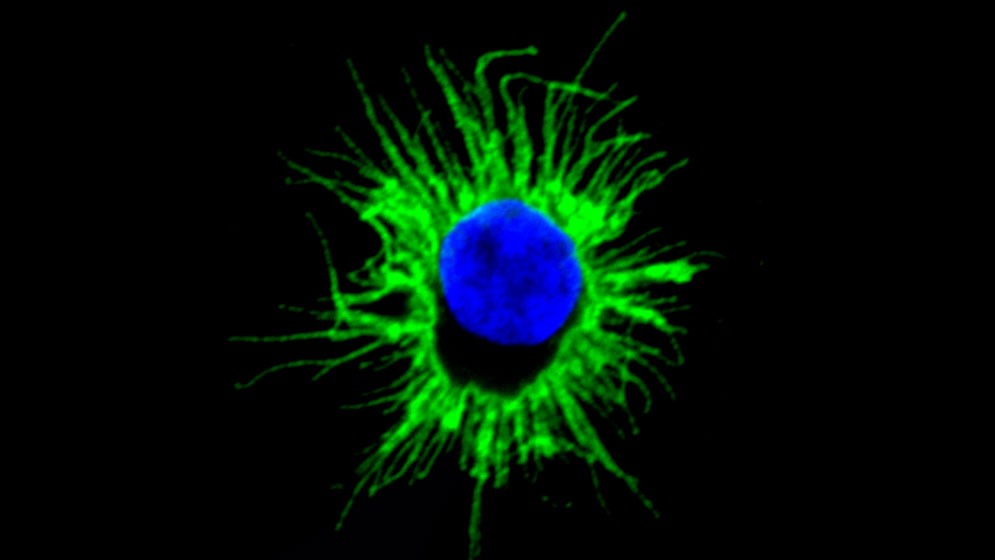
En los próximos meses se realizarán estudios preclínicos para comprobar su capacidad para reconocer y eliminar tumores. La investigación se describe en la revista Cell Reports.
Especialistas del CONICET lideraron el desarrollo de un camino alternativo y novedoso para generar un tipo de células –llamadas dendríticas– que en estudios in vitro demostraron tener una muy alta capacidad a fin de activar la respuesta inmune adaptativa, muy superior respecto de otros procedimientos usualmente empleados en la obtención de las mismas. El avance, que se describe en Cell Reports, podría tener interesantes aplicaciones en el campo del tratamiento para diferentes tipos de tumores.
“Dada su alta capacidad inmunógénica, estabilidad y refractariedad a la acción de diferentes agentes inmunosupresores, probaremos en los próximos meses, su capacidad antitumoral en modelos experimentales in vivo. En caso de tener resultados alentadores, el siguiente paso será desarrollar ensayos clínicos que demuestren su seguridad y eficacia”, afirma Jorge Geffner, investigador del CONICET en el Instituto de Investigaciones Biomédicas en Retrovirus y SIDA (INBIRS, CONICET-Facultad de Medicina, UBA).
El estudio fue liderado por Geffner y Fernando Erra Díaz, investigador del CONICET en el INBIRS, y forma parte de un proyecto conjunto con Gabriel Rabinovich y Tomas Dalotto Moreno, investigadores del CONICET en el Instituto de Biología y Medicina Experimental (IBYME, CONICET), quienes son también autores del trabajo.
En los últimos años diferentes líneas de investigación han impulsado el desarrollo de la inmunoterapia contra el cáncer, es decir tratamientos que inducen al sistema inmunológico a reconocer y eliminar el tumor. En ocasiones como primera línea de ataque o como complemento de métodos más tradicionales (cirugía, radioterapia o quimioterapia), la inmunoterapia ha revolucionado el tratamiento de las enfermedades oncológicas. En este sentido, los hallazgos más promisorios han sido obtenidos mediante el empleo de anticuerpos dirigidos contra moléculas que suprimen la respuesta inmune (puntos de chequeo inhibitorio).
Un procedimiento alternativo consiste en el desarrollo de vacunas a “células dendríticas”. ¿Cuál es el fundamento de las mismas? Las células dendríticas representan un elemento clave en la respuesta inmune: son las responsables de poner en marcha la respuesta inmune adaptativa y orientar su funcionalidad. La posibilidad de inmunizar al paciente oncológico con células dendríticas propias, cargadas en el laboratorio con antígenos tumorales, representa una estrategia razonable y prometedora. Ha sido probada en modelos experimentales y en numerosos ensayos clínicos realizados en pacientes con diferentes tipos de tumores (gliomas, melanoma, sarcomas, cáncer de próstata, mama y ovario). Sin embargo, los resultados en este campo han sido desalentadores. “El tumor ha mostrado capacidad de ‘domesticar’ a las células dendríticas transferidas, anulando su capacidad inmunogénica. En consecuencia, el éxito de esta terapia dependerá de la obtención de células dendríticas que, aún en un entorno tumoral, mantengan intacta su capacidad inmunogénica”, explica Geffner.
El nuevo trabajo sienta las bases para explorar el desarrollo de una nueva generación de vacunas a células dendríticas.
Procedimiento novedoso
Las células dendríticas tienen la particularidad de gobernar el curso de la respuesta inmune, ya que son las únicas capaces de activar al protagonista central de la respuesta inmune adaptativa: los linfocitos T que cumplen un papel crítico en la defensa frente a infecciones y al cáncer.
Las células dendríticas pueblan los diferentes tejidos de nuestro organismo. Pueden obtenerse también en el laboratorio, a través de un simple procedimiento que consiste en purificar monocitos (células de la inmunidad innata) a partir de una muestra de sangre del paciente para luego cultivarlos en presencia de citoquinas que promueven su diferenciación en células dendríticas, inhibiendo su diferenciación en un camino alternativo conducente a su diferenciación en macrófagos.
A partir de la década de 1980 se tipificaron diferentes procedimientos a fin de obtener células dendríticas diferenciándolas a partir de monocitos. Sin embargo, al intentar emplearlas en el tratamiento de tumores, se encontró una y otra vez, que las propiedades originales de las células dendríticas transferidas al paciente eran subvertidas por el propio tumor, anulando su capacidad de activar una respuesta inmune antitumoral. “Más aún, el tumor ‘domesticaba’ a las células dendríticas ‘obligándolas’ a producir factores que el tumor necesitaba para su propio crecimiento”, indica Geffner.
El trabajo desarrollado por el equipo de investigación del CONICET es esperanzador, al demostrar que la inhibición de dos vías metabólicas centrales de monocitos humanos, mediadas por las proteínas mTORC1 y PPARg, conduce a la obtención de células dendríticas con notables propiedades inmunogénicas.
En los próximos meses el equipo de investigación desarrollará un conjunto de experiencias a fin de analizar las propiedades antitumorales de estas células dendríticas, in vivo, en modelos experimentales.
“Este estudio, realizado íntegramente en células humanas, abre un horizonte inmenso en el tratamiento de tumores resistentes a otros tipos de terapias y estos son los que utilizaremos en modelos experimentales en nuestros próximos ensayos”, afirma Rabinovich.
Del estudio también participaron Ignacio Mazzitelli, Lucía Bleichmar y Claudia Melucci, del INBIRS; y Duygu Ucar, Asa Thibodeau y Radu Marches, del Laboratorio Jackson de Medicina Genómica, en Farmington, Estados Unidos.
Referencia bibliográfica: Diaz, F. E., Mazzitelli, I., Bleichmar, L., Melucci, C., Thibodeau, A., Dalotto-Moreno, T., Marches, R, Rabinovich, G.A., Ucar D. & Geffner, J. (2023). Concomitant inhibition of PPARγ and mTORC1 induces the differentiation of human monocytes into highly immunogenic dendritic cells. Cell Reports, 42(3). https://doi.org/10.1016/j.celrep.2023.112156

















Seguinos