CIENCIA Y TECNOLOGíA
16 de septiembre de 2022
Identifican un mecanismo generalizado que emplea una familia de virus para iniciar infecciones
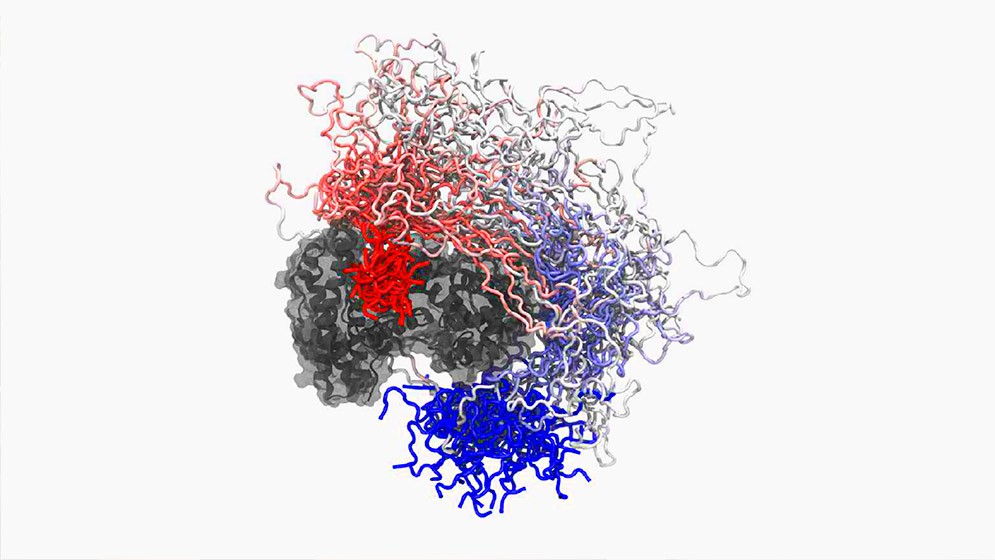
La función biológica descrita por especialistas del CONICET podría estar operando en proteínas asociadas a Alzheimer, cáncer y otras condiciones. Los estudios se describen en la revista Nature Structural & Molecular Biology.
Un equipo de investigación del CONICET identificó una función biológica conservada en una proteína de adenovirus, que es requerida para el inicio del proceso infeccioso. La mayoría de estos patógenos no causan enfermedades graves en humanos, pero están asociados a condiciones del tracto respiratorio como neumonía, y también gastroenteritis, conjuntivitis y hepatitis, entre otras.
La molécula estudiada pertenece a una clase de proteínas denominadas “intrínsecamente desordenadas” (IDPs según sus siglas en inglés) que, con el desarrollo de nuevas tecnologías, comenzaron a estudiarse mejor en los últimos años. El trabajo se publicó en la revista Nature Structural & Molecular Biology.
“Nuestro trabajo describe un mecanismo molecular conservado en los adenovirus, pero sugiere que se investigue si este mecanismo también está conservado en otras IDPs involucradas en las infecciones causadas por muchos virus, en el funcionamiento celular normal, y en enfermedades como el cáncer, el Parkinson, el Alzheimer y otras. Si fuera así, estos conocimientos podrían extrapolarse para entender cómo funciona esta nueva clase de proteínas, y asistir en la búsqueda de terapias novedosas para inactivar a las IDPs y tratar múltiples condiciones”, afirma Lucía Chemes, directora del estudio, investigadora del CONICET y jefa del Laboratorio de Estructura, Función y Plasticidad de Proteínas del Instituto de Investigaciones Biotecnológicas (IIBiO, CONICET-UNSAM).
Las IDPs incluyen a muchas proteínas importantes para la salud. Por ejemplo, la proteína beta amiloide y la alfa-sinucleína son IDPs que cumplen un rol central en la enfermedad de Alzheimer y Parkinson respectivamente. Muchos virus utilizan IDPs para iniciar procesos infecciosos que pueden conducir al desarrollo de cáncer. “Uno de esos casos es la oncoproteína E7 del Virus del Papiloma Humano (VPH). Esta IDP inactiva a la proteína celular Retinoblastoma (Rb), que es supresora de tumores y causa un cáncer de gran importancia para la salud como es el cáncer de cuello uterino”, agrega Nicolás González Foutel, primer autor del trabajo, que formó parte de su tesis doctoral, y ahora becario posdoctoral en el departamento de Biología Molecular y Genética de la Universidad de Aarhus, Dinamarca.
Al igual que VPH, los adenovirus inactivan a Rb como paso previo para replicar el genoma viral e iniciar el proceso infeccioso dentro de las células infectadas. Ahora el trabajo liderado por Chemes explica a nivel molecular cómo las IDPs de una familia entera de adenovirus se unen a Rb con alta afinidad, para bloquear su actividad.
Estrategia de “anclaje”
Las y los especialistas del CONICET emplearon como modelo de estudio la interacción de la proteína intrínsecamente desordenada E1A del “adenovirus humano 5” con Rb. Primero, realizaron estudios in vitro con ambas proteínas purificadas y midieron la fuerza de interacción entre ambas proteínas. “Esta fuerza se conoce como afinidad y la analizamos en detalle a nivel molecular”, resalta González Foutel.
Mediante el empleo de métodos de biología estructural como la resonancia magnética nuclear y dispersión de rayos X, el equipo de investigación logró demostrar que la proteína E1A emplea dos regiones llamadas “motivos lineales” (SLiMs según sus siglas de inglés) para interactuar con Rb. Los motivos lineales se encuentran unidos por una región flexible, llamada “linker”, la cual permite que ambos motivos cooperen entre sí para unirse a Rb. Este mecanismo de “anclaje” (por tethering en inglés) explica cómo E1A logra unirse con alta afinidad a Rb e inactivarla.
En experimentos adicionales, el equipo de investigación del CONICET comprobó que la afinidad de E1A de otros adenovirus por Rb era similar. “Los resultados indicaron que esa proteína en diferentes adenovirus emplea el mismo mecanismo de ‘anclaje’”, afirma Chemes.
“Por otra parte, utilizando herramientas bioinformáticas pudimos generalizar los descubrimientos experimentales a una familia compuesta por una centena de adenovirus que infectan a humanos y otros mamíferos”, destaca Juliana Glavina, también primera autora del estudio y becaria posdoctoral del CONICET en el IIBiO.
“Pudimos demostrar que el carácter desordenado y flexible de E1A era fundamental para el mecanismo de ‘anclaje’ de esa familia de adenovirus. Además, los resultados nos sugieren que este mecanismo podría estar conservado en muchas otras IDPs”, agrega Chemes.
Si bien el desarrollo de fármacos contra IDPs se encuentra en estadios tempranos, es posible que el conocimiento de los mecanismos descritos en el estudio liderado por los y las especialistas del CONICET ayude en el futuro diseño de moléculas o fármacos novedosos. “Por ejemplo, medicamentos que estabilicen a la proteína Rb, supresora de tumores, o inhibidores de IDPs que inactiven a Rb podrían ser un fin deseable en la lucha contra el cáncer. Los resultados de nuestro trabajo aportan datos que estimulan un amplio abanico de investigaciones que puedan comenzar a responder esas preguntas”, concluye Chemes.
Referencia bibliográfica: Gonzalez-Foutel, N. S., Glavina, J., Borcherds, W. M., Safranchik, M., Barrera-Vilarmau, S., Sagar, A., … & Chemes, L. B. (2022). Conformational buffering underlies functional selection in intrinsically disordered protein regions. Nature Structural & Molecular Biology.






















Seguinos